人工細胞膜のリポソームは、細胞膜の主成分であるリン脂質が二重膜を形成しています。リン脂質二重膜構造は細胞膜と同様な構造を有していることから、古くからリポソームは細胞膜のモデル研究に利用されてきました。細胞と同じサイズの巨大リポソームを研究対象として、化学・生物学・機械工学の知識を融合して、リン脂質組成非対称膜リポソームの構築や、膜タンパク質の再構成法の開発により膜タンパク質の機能観察を行っています。
最終的には、複雑な細胞内システムをブロックのようにリポソームへ再構成することで、ある一つの機能において細胞を凌駕する人工細胞を構築し、医療や環境問題等の解決や生命の起源の理解を目指します。
細胞膜の膜組成を模倣した人工細胞膜リポソームの構築
真核細胞膜のリン脂質二重膜の組成は、内膜と外膜で異なるリン脂質から構成されたリン脂質組成非対称膜になっております。古典的なリポソーム作製法ではリン脂質を混和して作製するため、リン脂質組成非対称膜をもったリポソーム作製は困難です。近年、マイクロデバイスの利用によるリン脂質非対称膜リポソーム作製法が考案されていますが、リポソームの安定性の面で問題があります。そこで、安定なリン脂質非対称膜リポソームの作製を考案しました。
安定な脂質非対称膜リポソーム作製と生体分子の相互作用研究
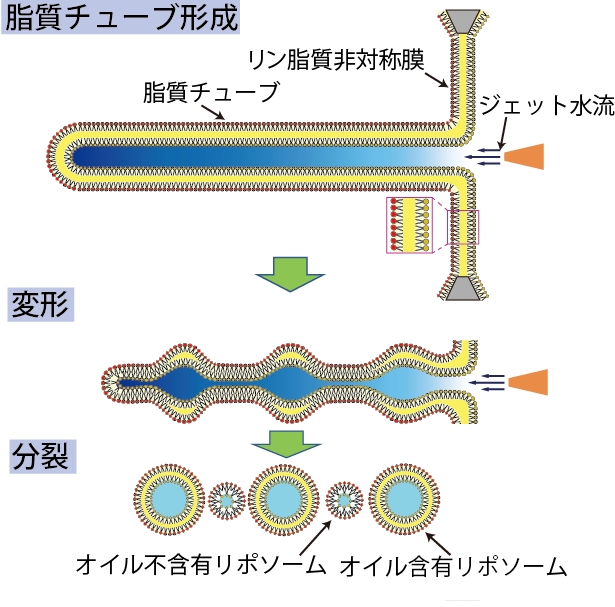
マイクロデバイス内で平面のリン脂質非対称膜を作製し、この平面リン脂質非対称膜にジェット水流を印加することにより、シャボン玉のようにリポソームを形成する方法を考案しました(左図) [1]。安定なリン脂質非対称膜リポソームであるため、リン脂質非対称膜上でリン脂質の分子運動やペプチドの相互作用観察に成功しています。このリン脂質非対称膜リポソームは、リン脂質のみで構成されているため、膜と相互作用する生体分子の素反応を観察できます。リン脂質非対称膜であると膜タンパク質の取込み挙動が変化することが分かりました。これは、なぜ生体膜はリン脂質非対称膜であるかという答えの一つであると考えられます。また、ナノサイズのリン脂質非対称膜リポソームの形成 [2]や糖脂質非対称膜リポソーム形成にも成功しています[3]。
[1] Kamiya et al., Nature Chemistry Vol. 8 (2016) pp.881-889.link[2] Kamiya et al., Sensors and Actuators B: Chemical Vol. 327 (2021) 128917.link
[3] Kamiya et al., Micromachines Vol. 12 (2021) 133.link
神谷ら、生物物理 (2018) Vol.58 No.6 pp.291-296.
神谷ら、生化学 (2018) Vol.90, pp.225-229.link
様々なリン脂質非対称膜リポソームの自動作製デバイス

円形のテーブルに存在するウェルを回転させることにより、様々な組成の平面のリン脂質非対称膜が作製が可能です。これらの平面のリン脂質非対称膜にジェット水流を印加することにより、1つのデバイスで複数種類の非対称膜リポソームの形成に成功しました。デバイスの回転によるリン脂質の混和が起こらないことも証明しています[4]。ステッピングモータにより回転角と速度を制御し、リポソームの自動作製機構を構築しました。また、平面膜が形成される最適な回転速度も分かりました[5]。
[4] Gotanda and Kamiya et al., Sensors and Actuators B: Chemical Vol. 261 (2018) pp.392-397.link[5] Gotanda and Kamiya et al., Sensors and Actuators B: Chemical Vol. 292 (2019) pp.57-63.link
真核細胞の形質膜と小胞膜組成を模倣したリポソーム形成
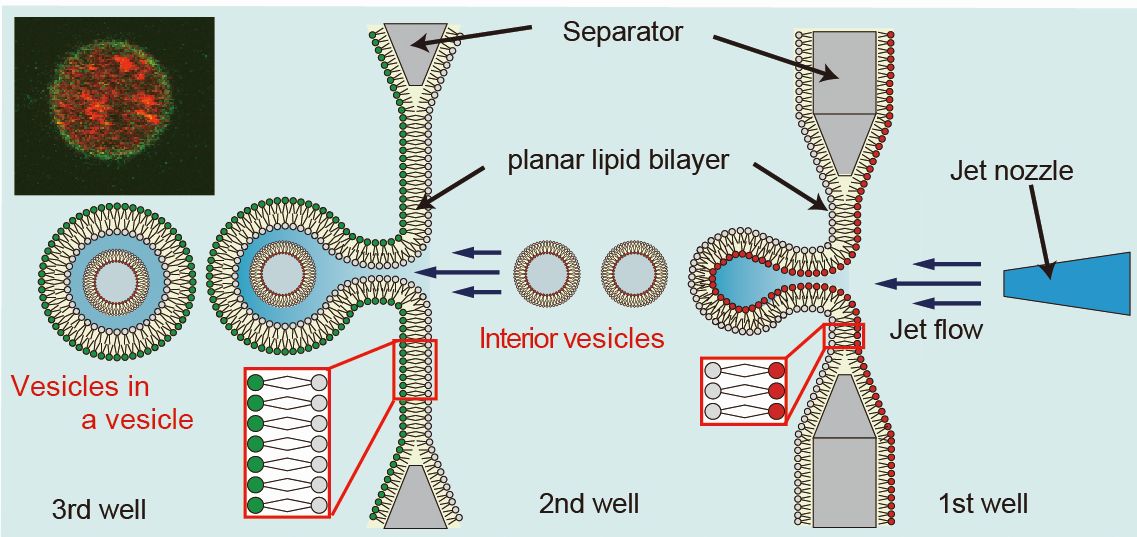
真核細胞の形質膜と小胞膜の内膜と外膜の組成は真逆の組成になっています。例えば、形質膜の外膜にはホスファチジルコリンやスフィンゴミエリンが多く存在し、内膜にはホスファチジルセリンやホスファチジルエタノールアミンが多く存在しています。一方、小胞膜の内膜にホスファチジルコリンやスフィンゴミエリンが多く存在しています。したがって、形質膜と小胞膜の非対称性は真逆です。そこで、形質膜と小胞膜の非対称膜の関係を模倣したリポソームを作製するために、3つのウェルからなるデバイスに2枚のリン脂質非対称膜を形成させ、ジェット水流を印加することで真核細胞の形質膜と小胞膜の非対称性を模倣したリポソーム作製に成功しました [6]。さらに、小胞の融合観察にも成功しています。
[6] Kamiya et al., RSC Advances, Vol. 9 (2019) pp.30071-30075.link膜透過ペプチドを介した水溶性タンパク質の非対称膜リポソーム内への輸送
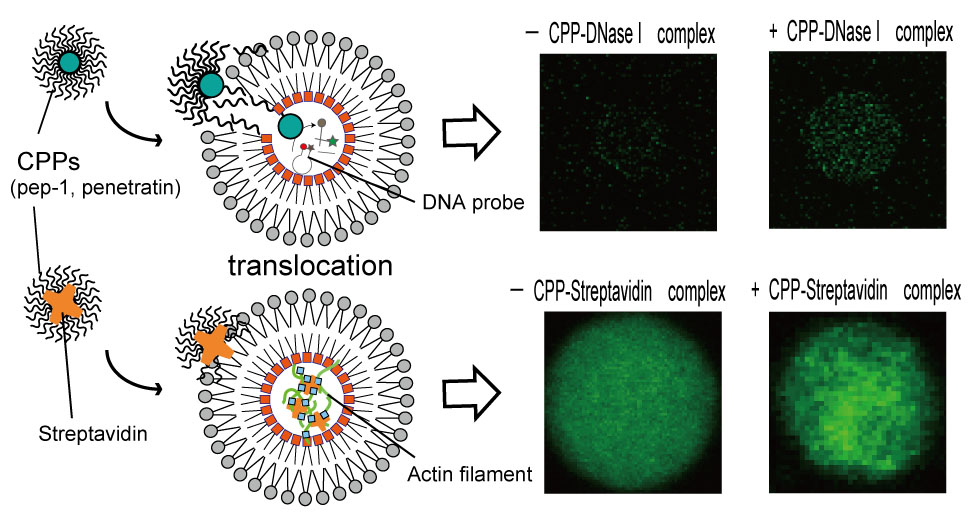
内膜に負電荷リン脂質、外膜に中性リン脂質によるリン脂質非対称膜リポソームであると、膜透過ペプチドを介して酵素などの水溶性タンパク質をリポソームの外側から内側に輸送することに成功しました。この輸送には、膜電位の発生が重要でありリン脂質非対称膜でないと水溶性タンパク質がリポソーム内へ輸送されないことを明らかにしました。この方法は、リポソーム内へでの酵素反応の開始制御をできるツールとして役立ちます。
[7] Miwa and Kamiya*, ACS Synthetic Biology, Vol. 11 (2022) pp.3836-3846. link Supplementary Coverリン脂質ー両親媒性タンパク質非対称膜小胞の形成
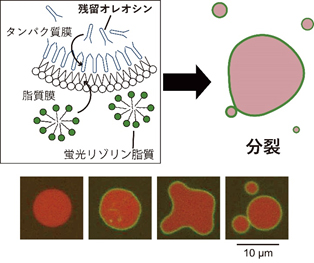
タンパク質膜とリン脂質膜の利点をあわせもつ、外膜:リン脂質、内膜:両親媒性タンパク質の細胞サイズ非対称膜小胞の形成に成功しました。この非対称小胞へ膜タンパク質の機能を有して挿入できることを明らかにしました。さらに、外液にリゾリン脂質を加えることでリポソームに比べて容易に、この非対称膜小胞が成長・分裂することができます[8]。この非対称膜小胞は、分裂能をもった人工細胞モデル構築研究への貢献が期待されます。さらに、この非対称膜ベシクルを用い、膜環境変化の情報を機械受容チャネルMscLによって小胞内へ伝達し、小胞内で酵素などによる薬剤産生等の有用な反応に変換できるマイクロ生体分子ロボットの構築が可能です[9]。
[8] Suzuki and Kamiya* iScience, Vol.26 (2023) 106086. link[9] Baba and Kamiya* ACS Applied Materials & Interfaces, Vol.16 (2024) pp.21623-21632. link Supplementary Cover
膜タンパク質の機能解析と工学的利用
細胞膜に存在しているタンパク質を膜タンパク質といいます。膜タンパク質は、細胞内外の物質輸送やシグナル伝達等の細胞に重要な機能を司っています。膜タンパク質は創薬のターゲットとして有望なため、膜タンパク質の機能解析研究が進められています。リポソームに膜タンパク質を再構成したプロテオリポソームによる膜タンパク質の機能解析は、精製された単一種類の膜タンパク質自身の素反応を詳細に解析可能です。さらに、膜タンパク質の機能を応用した人工細胞モデル構築も目指しています。
界面活性剤を用いないプロテオリポソーム作製法
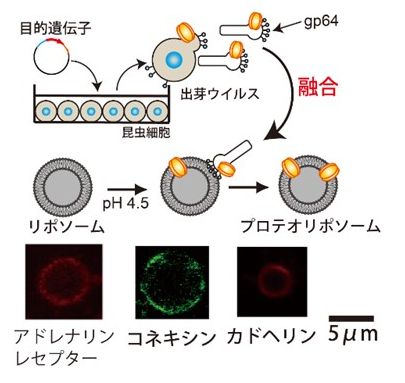
一般的に膜タンパク質を細胞から界面活性剤を用いて抽出します。界面活性剤により膜タンパク質が失活したり、リポソームに膜タンパク質を再構成した際、膜タンパク質の配向性が揃わない問題点があります。そこで、界面活性剤を用いないバキュロウイルスの膜融合能を利用したプロテオリポソーム作製法を確立し、アドレナリンレセプター[1]、コネキシン[2]、カドヘリン[3] 等の膜タンパク質の機能観察に成功しています。特に、カドヘリンリポソームは、ガン細胞に特異的に結合し、カドヘリンリポソームは効率的に細胞内へ取り込まれることを発見しました。これは、膜タンパク質を利用した新しいドラッグデリバリーシステム(DDS)が構築可能となります。
[1] Kamiya et al., Biochimica et Biophysica Acta – Biomembranes Vol. 1798 (2010) pp. 1625-1631.link[2] Kamiya et al., Biotechnology and bioengineering, Vol. 107 (2010) pp. 836-843. link
[3] Kamiya et al., Biomaterials, Vol. 32 (2011) pp.9899-9907. link
細胞小器官に発現しているイオンチャネル計測
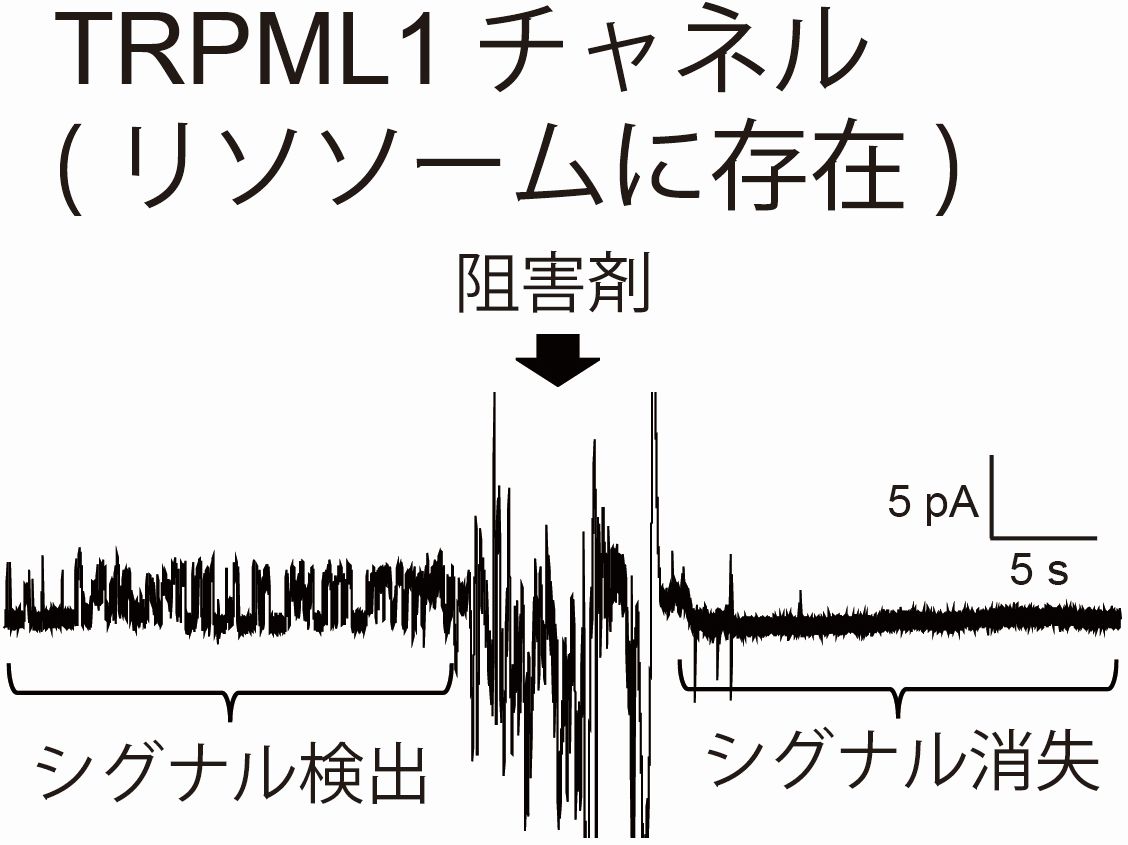
界面活性剤を使用せずに超音波破砕と遠心処理により、細胞からイオンチャネルを含む粗精製の膜画分を作製します。パッチクランプアンプに接続した人工平面膜デバイスに、この膜画分を加えることで、イオンチャネルが平面膜へ移行しイオンチャネルシグナルを測定できます。この方法で、形質膜に存在するhERG, TRPV1のイオンチャネルシグナルの取得に成功しています。また、細胞小器官に発現しているイオンチャネル(TRPML1やRyR)の機能計測にも成功しています[4]。
[4] Kamiya et al., Scientific Reports, Vol. 8 (2018) 17498. linkグラム陰性菌外膜に存在する膜タンパク質の機能改変と工学応用
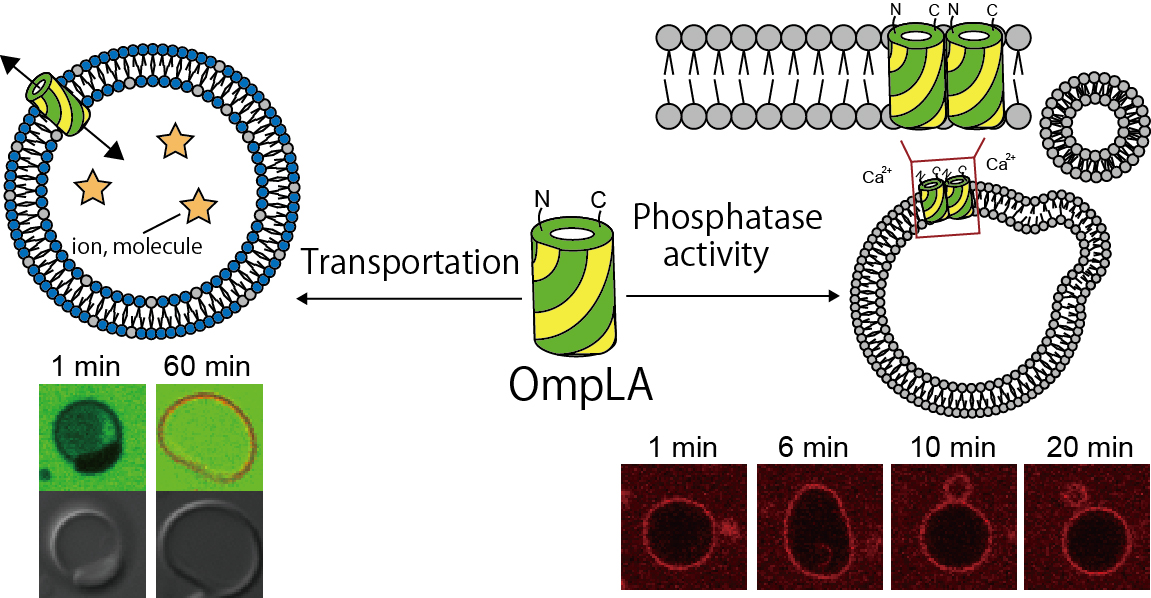
大腸菌の外膜に存在するouter membrane proteinの1つのOmpLAは12本のβストランドから構成されています。カルシウムイオン存在下で2量体を形成しリン脂質のアルキル鎖を切断するホスホリパーゼ活性をします。パッチクランプ測定によりOmpLAはイオンを透過させる機能も有すことが分かりました。そこで、OmpLAを再構成したリポソーム内への蛍光物質の理流入に成功し、カルシウムイオン存在下でホスホリパーゼ活性によりリン脂質を切断し、リポソーム膜の変形が強くなり小胞が出芽する様子を観察されました[5]。OmpLAを介して物質輸送と小胞の出芽が可能です。OmpGのβストランドを増減させることでポア直径の大きさを変えることに成功し、改変OmpGによってDNAの形状の違いを認識できました[6]。また、OmpGやOmpAを無細胞タンパク質発現系にて発現させ、ポアが形成されることが明らかになりました[7]。さらに、OmpGの効率的なリポソームへの再構成法を確立し、リポソームへの物質輸送に成功しています[8]。
[5] Ohnishi and Kamiya*, ACS Synthetic Biology, Vol. 10 (2021) 1837-1846. link[6] Tosaka and Kamiya*, ACS Applied Nano Materials, Vol. 5 (2022) pp.6149-6158. link Supplementary Cover
[7] Kamiya*, Scientific Reports, Vol. 12 (2022) 2376. link
[8] Tosaka and Kamiya*, ACS Omega, Vol. 9 (2024) pp.5911-5918. link
酵素-DNA複合体による酵素複合体ネットワーク形成
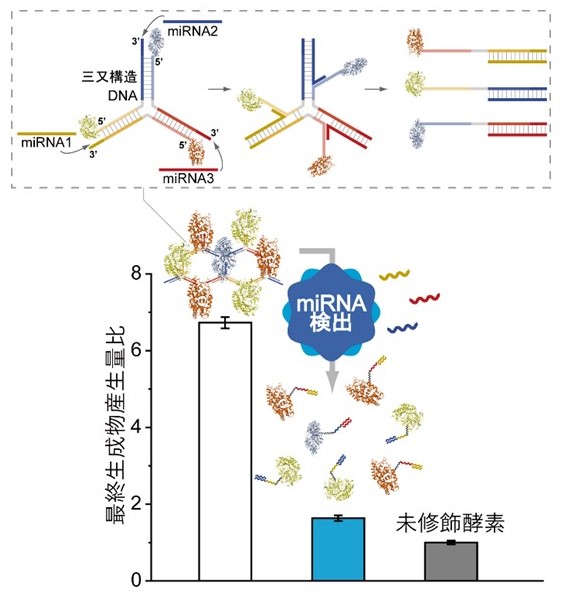
酵素の近接と分離を動的に変化させた酵素反応の制御をしたバイオリアクタの創成を目標とし,相補鎖RNAなどの生体分子の外部刺激に応答して一本鎖への分離と二本鎖の形成を繰り返すDNA鎖を結合した酵素複合体を作製しました。酵素同士の近接によって、最終的に得られる生成物の量が遊離状態の酵素を用いた時の約7倍にまで増加したことを明らかにしました。酵素同士をつなぐDNAに3種のmiRNAを認識する配列をもたせた酵素-DNA複合体を作製することで、乳がん患者が特異的にもつ3種のmiRNA存在下で分離して酵素反応を抑制するシステムを構築しました。この酵素の近接と分離を動的に変化させたシステムは、がん診断バイオセンサや環境センシング、エネルギー生産のためのバイオリアクタとしての応用が期待されます[9]。
[9] Mameuda Takinoue and Kamiya*, Analytical Chemistry, Vol. 95 (2023) pp.9548-9554. link Supplementary Cover化学・生物学分野へ応用するマイクロデバイスの開発
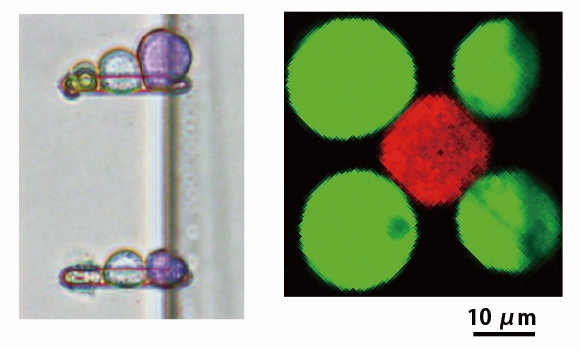
微細加工技術を用いることによりマイクロサイズの微小流路を作成することが可能です。微小流路は、体積よりも表面積の効果が支配的になるので、反応や温度制御を迅速に正確に行うことができます。近年、化学や生物分野の研究で広く用いられている技術です。
対数濃度勾配を作成可能なマイクロデバイスを考案し、膜タンパク質の薬物阻害曲線を簡便に作成することが可能になりました[1]。静水圧を利用して、細胞を任意の順番や形状で並べるデバイスを考案しています(図)[2]。このデバイスは、空間的に細胞を制御した状態で細胞間相互作用が観察でき、詳細な細胞間相互作用の理解が可能になります。
リン脂質組成非対称膜リポソームの作成においてもマイクロデバイスを利用しています。
[1] Abe and Kamiya et al., Analyst, Vol. 140 (2015) pp.5557-5562.link
[2] Kamiya et al., Advanced Healthcare Materials, Vol.7(2018)1701208. link